構造式および分子式:アセチレン
アセチレンの構造の特徴は、その特性、製造および用途に影響を及ぼす。物質 - Cの従来の指定2H2 その最も単純で肉眼的な式です。 アセチレンは2つの炭素原子によって形成され、その間に三重結合が存在する。その存在は、エチレン分子の異なる種類の式およびモデルを反映し、物質の性質に対する構造の影響の問題を理解することを可能にする。
アルキン。一般式。アセチレン
アルキル炭化水素、またはアセチレンは、非環式、不飽和。炭素原子の鎖は閉鎖されておらず、その中には単純かつ多数の結合が存在する。アルキンの組成は、要約式CnH2n - 2。このクラスの物質の分子には、1つ以上の三重結合を含む。アセチレン化合物とは、不飽和化合物をいう。これは、水素のために1価の炭素しか実現されないことを意味する。残りの3つの結合は、他の炭素原子と相互作用するときに使用される。
最初の有名な代表者アルキン - アセチレン、またはエチンである。物質の些細な名前は、ラテン語の "アセタム" - "酢"とギリシャ語 - "ハイル" - "ツリー"から来ています。相同系列の創始者は1836年に化学実験で発見され、その後、物質はE. DavyとM. Bertlo(1862)によって石炭と水素から合成された。常温常圧では、アセチレンは気体状態にある。これは無色の無臭の気体で、わずかに水に溶けます。エタノールはエタノールとアセトンに容易に溶解します。

アセチレンの分子式
その相同系列の最も単純なメンバーであるEtinは、その組成と構造が次の式を反映しています:
- C2H2 エタン組成の分子記録ある物質が2つの炭素原子と同じ数の水素原子によって形成されるという概念。この式によれば、化合物の分子量および分子量を計算することができる。氏(From2H2)= 26a。すなわち、M(C2H2)= 26.04g / molであった。
- Н:С:::С:Н - アセチレンの電子ドット式。 同様の画像は、「ルイス構造」と呼ばれ、分子の電子構造を反映している。書き込む際には、規則を遵守する必要があります。水素原子は、化学結合の形成におけるヘリウムの原子価殻の構成を取る傾向があり、他の要素は、外部電子のオクテットです。各コロンは、外部エネルギー準位の2つの原子または非共有電子対の共通を意味する。
- H-C≡C-Hは、アセチレンの構造式であり、原子間の結合の秩序および多重度を反映する。 1対の電子を1つのダッシュで置き換えます。
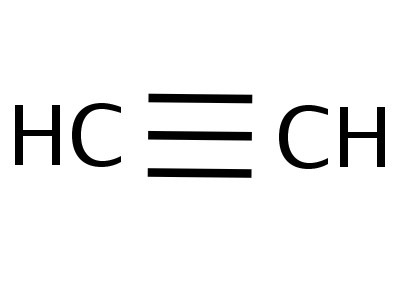
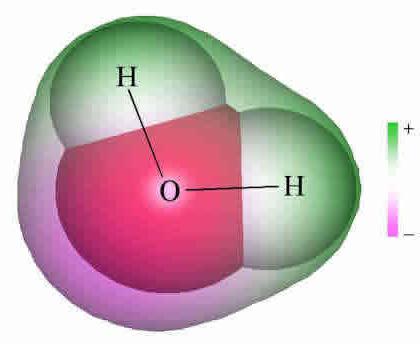
アセチレン分子のモデル
電子の分布を示す式、原子軌道モデルの作成、分子の空間的定式化(立体化学)の基礎として役立った。 18世紀の終わりには早くも球状のロッドモデルが広く普及しました。例えば、異なる色と大きさのボールで、アセチレンを形成する炭素と水素を指定します。分子の構造式は、棒の形で表され、化学結合と各原子におけるそれらの数を象徴する。

アセチレンの球状モデルが再現される原子価の角度は180°に等しいが、分子内の核間距離はおよそ反映される。ボール間の空隙は、電子密度の原子空間の充填の写真を生成しない。 Dridingのモデルでは欠点が排除されています。Dridingはボールのない原子核を指定していますが、ロッド同士の結合点はありません。現代の容積モデルは、原子および分子軌道のより鮮明な考えを与える。
アセチレンのハイブリッド原子軌道
励起状態の炭素は3つのp軌道を含み、1つは不対電子を含む。メタン(CH4) 彼らは等価物の作成に参加する水素原子と結合する。有名なアメリカの研究者L. Paulingは、原子軌道(AO)のハイブリッド状態の理論を開発しました。化学反応における炭素の挙動の説明は、形態とエネルギーにおけるAOの整列、新しい雲の形成である。ハイブリッド軌道はより強い結合を与え、式はより安定する。
これとは対照的に、アセチレン分子中の炭素の原子メタンは、sp-ハイブリダイゼーションを受ける。 Sとp電子は形状とエネルギーが混在している。 2つのsp軌道は、180°の角度で横たわり、核の反対側に向けて現れる。

トリプル接続
炭素のアセチレンハイブリッド電子雲同じ隣り合った原子とCH-対の水素とを有するσ-結合の生成に関与する。互いに直交する2つの非ハイブリッドp軌道が残っている。エチレン分子においては、それらは2つのπ結合の形成に関与する。 σと一緒に、構造式を反映する三重結合が存在する。アセチレンはエタンとエチレンとの間の距離によって異なる。トリプルボンドはダブルよりも短いが、より大きなエネルギーを持っており、より強固です。 σ結合とπ結合の最大密度は、垂直領域に位置し、円筒状の電子雲が形成される。
アセチレン中の化学結合の特徴
エチレン分子は直線状であり、これは成功しているアセチレン-H-C≡C-Hの化学式を反映している。炭素原子と水素原子は直線に沿っており、それらの間に3つのσ-結合と2つのπ-結合がある。自由な動き、軸C-Cに沿った回転は不可能であり、これは多重結合の存在によって防止される。三重結合の他の特徴:
- 2つの炭素原子を結ぶ電子対の数は3である。
- 長さ - 0.120nm;
- 破裂エネルギーは836kJ / molである。
比較のために、エタンおよびエチレン分子において、一重および二重化学結合の長さはそれぞれ1.54および1.34nmであり、C-C破断のエネルギーは348kJ / mol、C = C-614kJ / molである。

アセチレンの同族体
アセチレンはアルキンの最も単純な代表例であり、その分子もまた三重結合を有する。 Propyn CH3С≡СН - アセチレンの同族体。アルキンの第3の代表例の式 - ブチン-1-CH3CH2С≡СН。アセチレンはエタンの些細な名前です。アルキンの系統的命名法はIUPAC規則の対象となります:
- 直鎖状の分子中では、例えば、エチン、プロピン、ブチン-1のような三重結合を有する添え字-inとその数にギリシャ数字から生じる主鎖の名称が付け加えられている。
- 原子の主鎖の番号付けは、三重結合に最も近い分子の末端で開始する。
- 枝分かれした炭化水素の場合は、最初に側枝の名前が続き、続いて接尾辞-inの原子の主鎖の名前が続きます。
- 名前の最後の部分は、分子中の三重結合の位置を示す図であり、例えば、ブチン-2である。

アルキンの異性。構造物に対する物性の依存性
エチンおよびプロピンは、トリプルの異性体を有さない彼らはButinから始まります。炭素骨格の異性体は、ペンテンおよび以下の同族体中に存在する。アセチレン系炭化水素の空間異性は、三重結合に関しては現れていない。
最初の4つのエタノールホモログは、水に難溶性のガスです。アセチレン炭化水素C5 - C15 - 液体。固体は炭化水素Cから出発してエタンの同族体である17。アルキンの化学的性質三重結合の重要な影響。このタイプの炭化水素はエチレンよりも活性であり、様々な粒子が付着している。この特性は、産業および工学におけるエタンの広範な使用に基づいている。アセチレンを燃焼すると、大量の熱が放出され、金属のガス切断および溶接に適用される。
</ p>