電解質の性質。強い電解質と弱い電解質。電解質 - それは何ですか?
電流の優れた導体 - 金、銅、鉄、アルミニウム、合金。それと並んで、非金属物質の大きなグループがあり、その溶融物および水溶液も導電性を有する。これらは強塩基、酸、いくつかの塩、総称して「電解質」です。イオン伝導度とは何ですか?電解質がこの広範な現象にどのような関係があるかを見てみましょう。

どの粒子が電荷を持っていますか?
周囲の世界はさまざまな指揮者でいっぱいです。絶縁体。これらの身体および物質の特性は、古くから知られている。ギリシアの数学者タレス(Thales)は、アンバー(ギリシャ語では「電子」)で経験を積んだ。それを絹の上にこすって、科学者は毛髪の誘引現象、ウールの繊維現象を観察した。その後、アンバーは絶縁体であることが知られていた。この物質には、電荷を運ぶことができる粒子は存在しない。良導体は金属です。それらの組成には、原子、陽イオン、および自由で微小な負の粒子 - 電子がある。電流が流れたときに電荷転送を行います。乾燥形態の強力な電解質は、遊離粒子を含まない。しかし、溶解および溶融の間に、結晶格子は、共有結合の分極だけでなく、分解する。
水、非電解質および電解質。解散とは何ですか?
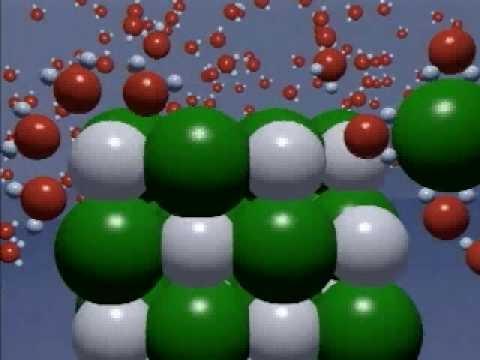
電子、原子金属および非金属元素はイオンに変換される。結晶格子内のそれらの間にかなり強い接続があります。イオン性化合物、例えば塩化ナトリウムの溶解または溶融は、その破壊をもたらす。極性分子では、結合イオンも遊離イオンもなく、水と相互作用するときに生じる。ファラデーは、XIX世紀の30年代にいくつかの物質の解が電流を導くことを発見しました。科学者は科学にそのような重要な概念を導入しました:
- イオン(荷電粒子)。
- 電解質(第2種の導体)。
- 陰極;
- アノード。
化合物 - 強い電解質があり、その結晶格子はイオンの放出によって完全に分解する。
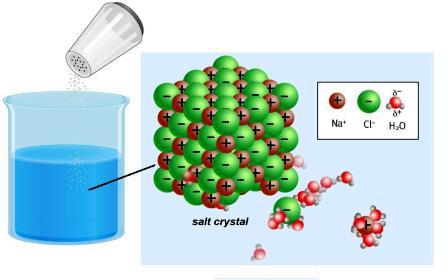
不溶性物質と糖、ホルムアルデヒドなどの分子形態で保存されています。このような化合物は非電解質と呼ばれる。それらのために、荷電粒子の形成は特徴的ではない。弱い電解質(石炭と酢酸、水酸化アンモニウム、その他多くの物質)にはイオンがほとんど含まれていません。
電解解離理論
彼の作品では、スウェーデンの科学者S. アレニウス(1859-1927)はファラデーの結論に依拠していた。その後、彼の理論の規定は、ロシアの研究者I.KablukovとV. Kistyakovskyによって明らかにされた。彼らは、溶解して溶解するとき、イオンが全ての物質を形成するのではなく、電解質のみを形成することを発見した。 S.アレニウス解離とは何ですか?これは分子の破壊であり、これは溶液および溶融物中に荷電粒子の出現をもたらす。 S.アレニウスの主な理論的規定:
- 溶液中の塩基、酸および塩は、解離した形態である。
- 可逆的にイオンの強い電解質に分解します。
- 弱いイオンは少数のイオンを形成する。

物質の解離度の指標(そのしばしばパーセンテージとして表される)は、イオンに崩壊した分子の数と溶液中の粒子の総数の比である。この指標の値が30%を超えると電解質が強く、弱い場合は3%未満です。
電解質の性質
S.の理論的結論 アレニウスは、ロシアの科学者によって行われた溶液と融解における物理化学的プロセスの後の研究によって補完された。塩基と酸の性質について説明した。第1のものは、陽イオンからの溶液のみが金属イオンを検出することができる化合物を含み、陰イオンはOH - 。酸の分子は酸残基のマイナスイオンに分解し、水素のプロトン(H+)。 溶液と溶融液中のイオンの動きは混沌としている。あなたがチェーンを組み立て、炭素電極と通常の白熱電球を含める必要がある実験の結果を考えてみましょう。共通の塩、酢酸、砂糖(最初の2つは電解質)の異なる物質の溶液の導電性を調べてみましょう。電気回路とは何ですか?これは一緒に接続された電流と導体のソースです。回路が閉じられると、電球は塩溶液中でより明るく輝く。イオンの動きは順序を取得する。陰イオンは正電極に向けられ、陽イオンは負電極に導かれる。

このプロセスでは、酢酸が関与する少量の荷電粒子。砂糖は電解質ではなく、電流を伝導しません。この溶液中の電極間には絶縁層があり、電球は焦げない。
電解質間の化学的相互作用
解決策が排水されると、彼らがどのようにリードするかを観察することができますあなた自身の電解質。同様の反応のイオン方程式は何ですか?例えば、塩化バリウムと硝酸ナトリウムとの間の化学的相互作用を考慮する:
2NaNO3 + BaCl2 + = 2NaCl + Ba(NO3)2.
電解質の式はイオンの形で書くことができます:
2Na+ + 2NO3- + Ba2+ + 2Cl - = 2Na+ + 2Cl - + Ba2+ + 2NO3-.
反応のために採取される物質は強い電解質である。この場合、イオンの組成は変化しない。電解質溶液間の化学的相互作用は、3つの場合に可能である:
1.製品の1つが不溶性物質である場合。
分子式:Na2SO4 + BaCl2 = BaSO24 + 2NaCl。
電解質の組成をイオンの形で書きましょう:
2Na+ + SO42- + Ba2+ + 2Cl - = BaSO24(白色沈殿物) + 2Na+ 2Cl - .
2.形成された物質の1つは気体である。
反応生成物の中には弱い電解質がある。

水は最も弱い電解質の1つです
化学的に純粋な水(蒸留)は電流を通さない。しかし、その組成には少量の荷電粒子が存在する。これらはプロトンH+ およびアニオンOH - 。無視できる数の水分子が解離する。値 - 水のイオン生成物であり、25℃の温度で一定である。それは、Hの濃度を知ることを可能にする+ およびOH - 。水素イオンは酸の溶液で優勢であり、水酸化物 - 陰イオンはアルカリでより大きい。ニュートラル - 数H+ およびOH - 。溶液媒体はまた、水素指数(pH)を特徴付ける。それが高いほど、より多くの水酸化物イオンが存在する。培地は、pH範囲が6-7に近い中性である。 Hイオンの存在下で+ およびOH - リトマス、フェノールフタレイン、メチルオレンジなどの色指示物質を変更する。
電解質の溶液と溶融物の性質産業、工学、農業および医学において広く使用されている。科学的正当化は、塩、酸、塩基が構成されている粒子の挙動を説明した数多くの著名な科学者の作品に書かれています。それらの溶液では、様々なイオン交換反応が起こる。それらは多くの工業プロセス、電気化学、電気メッキで使用されています。生物中のプロセスは溶液中のイオン間でも起こる。原子や分子の形で有毒な多くの非金属や金属は、荷電粒子(ナトリウム、カリウム、マグネシウム、塩素、リンなど)の形態で不可欠です。
</ p>