酵素の特異性:作用のタイプおよび特徴
「酵素」という言葉はラテン語のルーツを持っています。 翻訳では、それは "パン種"を意味します。英語では、「酵素」という用語は、同じことを意味するギリシャ語の用語に由来して使用されます。酵素は特殊タンパク質と呼ばれています。これらは細胞内で形成され、生化学過程の進行を促進する能力を有する。換言すれば、それらは生物学的触媒として作用する。何があるか考えてみましょう 酵素の作用の特異性。特異性のタイプ この記事でも説明します。

一般的な特性
いくつかの触媒活性の発現多くの非タンパク質化合物の存在によって引き起こされる。彼らは補因子と呼ばれています。それらは2つのグループに分かれています:金属イオンといくつかの無機物質、補酵素(有機化合物)。
活動の仕組み
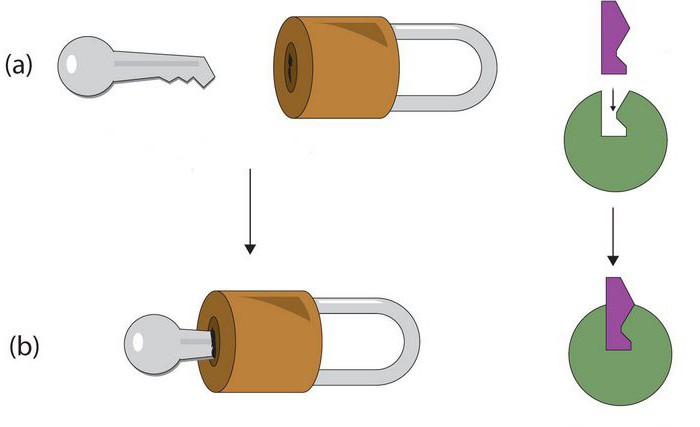
それらの化学的性質により、酵素はタンパク質群。しかし、後者とは異なり、検討中の要素にはアクティブな中心が含まれています。これは、アミノ酸残基の官能基の独特な複合体である。それらは、酵素の第三級または第四級構造のために、空間において厳密に配向されている。活性中心において、触媒および基板領域が分離される。後者は酵素の特異性を決定するものである。基質は、タンパク質が作用する物質である。以前は、彼らの相互作用は「鍵の鍵」の原則に従って行われていたと信じられていました。換言すれば、活性中心は基材に明確に対応していなければならない。現在、別の仮説が優先されている。正確な一致は最初は存在しないが、物質の相互作用の間に現れると考えられている。 2番目の触媒部位は作用の特異性に影響する。換言すれば、それは加速された反応の性質を決定する。

構造
すべての酵素は、二成分である。前者は単純なタンパク質の構造に類似している。それらは専らアミノ酸を含む。第2のグループ - タンパク質 - は、タンパク質および非タンパク質部分を含む。最後は補酵素、最初はアポ酵素です。後者は、酵素の基質特異性を決定する。つまり、アクティブセンターの基盤として機能します。コエンザイムは、それぞれ触媒領域として働く。行動の特異性はそれに関連している。補酵素としては、ビタミン、金属、その他の低分子化合物が作用します。
触媒作用
任意の化学反応の発生は、相互作用する物質の分子の衝突。システムにおけるそれらの動きは、潜在的な自由エネルギーの存在によって決定される。化学反応のためには、分子が遷移状態をとることが必要である。換言すれば、それらはエネルギーバリアを通過するのに十分な強度を有さなければならない。これは、すべての分子に反応性を与えるためのエネルギーの最小量を表す。酵素を含むすべての触媒は、エネルギー障壁を減少させることができる。これにより、反応の進行が促進される。

酵素の特異性は何ですか?
この能力は加速のみで表現されますある種の反応。酵素は同じ基質に影響を与えることができる。しかし、それぞれが特定の反応だけを加速します。酵素の反応特異性は、ピルビン酸デヒドロゲナーゼ複合体の例に遡ることができる。これは、PVCに影響を与えるタンパク質を含む。主なものは、ピルビン酸デヒドロゲナーゼ、ピルビン酸デカルボキシラーゼ、アセチルトランスフェラーゼである。反応自体は、PVCの酸化的脱カルボキシル化と呼ばれる。その製品は酢酸を作用するので。
分類
酵素特異性には以下のタイプがある:
- 立体化学。 これは、可能性のある基質立体異性体の1つに影響を及ぼす物質の能力において表される。例えば、フマル酸ヒドラターゼは、フマル酸に作用することができる。しかしながら、シス異性体 - マレイン酸には影響しない。
- 絶対。酵素の特異性 このタイプは、特定の基質のみに影響を与える物質の能力で表されます。例えば、スクロースは専らスクロース、アルギナーゼ、アルギニンなどと反応する。
- 相対的。酵素の特異性 この場合、物質の能力で表現される同じ種類の接続を有する基板のグループに対する影響。例えば、α-アミラーゼはグリコーゲンおよびデンプンと反応する。これらはグリコシド型結合を有する。トリプシン、ペプシン、キモトリプシンは、ペプチド群の多くのタンパク質に影響する。

温度
酵素は特異性を有する 特定の条件で。 ほとんどの場合、最適温度は+ 35〜+ 45℃です。物質がより低い指数の条件に置かれると、その活性は低下する。この状態を可逆失活といいます。温度が上がると、彼の能力が回復するでしょう。 tが指定された値よりも高い状態に置くと、不活性化も起こるということは意味があります。しかし、この場合、温度が低下すると回復しないため、不可逆的になる。これは、分子の変性に起因する。
pHの影響
分子の電荷は酸性度に依存する。 したがって、pHは、活性部位の活性および酵素の特異性に影響を及ぼす。各物質の最適酸度指数は異なります。しかし、ほとんどの場合、それは4-7です。例えば、アルファ唾液アミラーゼについては、最適酸度は6.8である。一方、いくつかの例外があります。ペプシンの最適酸度、例えば1.5-2.0、キモトリプシンおよびトリプシン-8-9。

濃度
より多くの酵素が存在するほど、より高い反応速度。基板の濃度についても同様の結論を導くことができる。しかし理論的には、物質の飽和含有量は物質毎に決定される。それによって、すべてのアクティブなセンターが既存の基板によって占有されます。この場合には、 酵素の特異性 その後のターゲットの追加にかかわらず最大になります。
物質調整剤
これらは、阻害剤および活性化剤に分けることができる。 これらのカテゴリーは両方とも、非特異的および特異的なものに分類される。後者のタイプのアビタイバーには、胆汁酸塩(膵臓のリパーゼ)、塩化物イオン(アルファ - アミラーゼ)、塩酸(ペプシン)が含まれる。非特異的活性化剤は、キナーゼおよびホスファターゼに影響を及ぼすマグネシウムイオンであり、特異的阻害剤は、プロ酵素の末端ペプチドである。後者は不活性な物質である。それらは、末端ペプチドの切断によって活性化される。それらの特定の型は個々のプロ酵素に対応する。例えば、不活性形態では、トリプシンは、トリプシノーゲンの形態で産生される。その活性中心は、特異的阻害剤である末端ヘキサペプチドで閉鎖されている。活性化の過程で、それは分裂する。この結果としてのトリプシンの活性中心は開いた状態になる。非特異的阻害剤は、重金属からの塩である。例えば、硫酸銅。それらは化合物の変性を引き起こす。
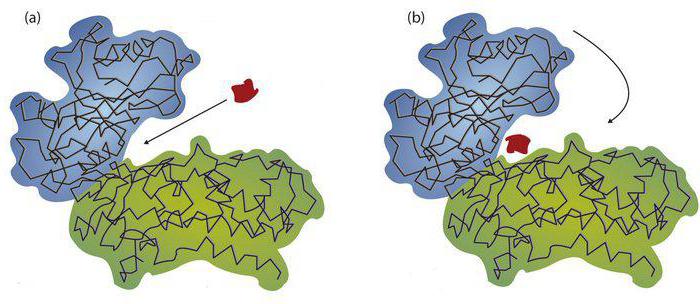
阻害
それは競争力があります。 この現象は、阻害剤と基質との間の構造的類似性の発生において発現される。彼らは活発なセンターとのコミュニケーションのための闘争に入ります。阻害剤の含量が基質の含量より高い場合、コプレックス酵素阻害剤が形成される。標的物質が添加されると、比が変化する。結果として、インヒビターは取り替えられるであろう。例えば、コハク酸デヒドロゲナーゼのコハク酸塩は、基質として作用する。阻害剤は、オキサロアセテートまたはマロネートである。反応生成物の影響は競合的であると考えられる。しばしばそれらは基質のようなものです。例えば、グルコース-6-リン酸については、生成物はグルコースである。基質はグルコース-6リン酸であろう。非競合的阻害は、物質間の構造的類似性を意味するものではない。阻害剤および基質は酵素に同時に結合することができる。これにより、新しい化合物が形成される。彼は複雑な酵素 - 基質 - 阻害剤である。対話中に、アクティブセンターがブロックされます。これは、阻害剤が活性部位の触媒部位に結合するためである。一例はシトクロムオキシダーゼである。この酵素の場合、酸素は基質として作用する。シトクロムオキシダーゼの阻害剤はシアン化水素の塩である。
アロステリック調節
場合によっては、アクティブセンターに加えて、酵素の特異性、もう一つのリンクがあります。アロステリック成分として。同名のアクチベーターが関連していると、酵素の有効性が増します。阻害剤がアロステリックセンターとの反応に入ると、その物質の活性はそれぞれ減少する。例えば、アデニレートシクラーゼおよびグアニル酸シクラーゼは、アロステリックタイプの調節を有する酵素を指す。
</ p>